2020年3月,全球首次批准新药主要集中在美国、中国、日本和加拿大。美国食品药品监督管理局(FDA)批准1个新分子实体药物(NME),用于治疗复发型多发性硬化症的Ozanimod。国家药品监督管理局(NMPA)批准NME药物2个,用于治疗非小细胞肺癌的Almonertinib Mesilate和治疗过敏性鼻炎的Bencycloquidium Bromide。日本医药品医疗器械综合机构(PMDA)批准2个NME,用于治疗非小细胞肺癌的Tepotinib hydrochloride hydrate和治疗原发性中枢神经系统淋巴瘤的Tirabrutinib hydrochloride。加拿大卫生部批准了用于治疗艾滋病的单药Cabotegravir及复方Cabotegravir/Rilpivirine。此外,FDA新批准生物制品1个,用于治疗多发性骨髓瘤的Isatuximab-irfc。

1.Ozanimod

Ozanimod于2020年3月25日获得美国食品药品监督管理局(FDA)批准上市,用于治疗成人的复发型多发性硬化症。该药由新基研发及上市,商品名为Zeposia®[1,2]。
多发性硬化症(MS)是涉及人体免疫系统的异常反应,直接针对中枢神经系统(CNS)的免疫介导过程[3]。多发性硬化症是进展性、致残性的疾病。据调研显示,我国多发性硬化的患者中83%为复发缓解型患者,58%的患者每年发作次数≥1次。这些患者中平均至少有一个神经功能残疾,并随着病程残疾程度逐渐加重[4]。

Zeposia®是一种小分子鞘氨醇-1-磷酸酯受体调节剂,可以与S1PR1和S1PR5高亲和性结合。Zeposia®选择性与S1P1结合被认为能够抑制活化淋巴细胞的特定子集迁移至炎症部位,从而减少可导致抗炎活性的循环T和B淋巴细胞水平,缓解免疫系统对神经髓鞘的攻击,并仍可维持免疫监视。Zeposia®选择性与S1P5结合被认为可激活中枢神经系统(CNS)内的特定细胞,这有可能增强髓鞘的再生,并预防突触缺陷,最终可以防止神经损伤[1]。
2017年2月,新基宣布Zeposia®在一个叫做SUNBEAM的临床三期试验(NCT02294058)中比百健的beta干扰素(商品名Avonex®)显著降低多发性硬化症患者的复发频率,达到试验主要终点。Zeposia®也比Avonex®减少新病灶的出现,这也是一个关键的次要终点。口服Zeposia® 2种剂量(1 mg和0.5 mg)的第2个大型临床三期试验RADIANCE Part B (NCT02047734)研究结果显示,经过2年时间的治疗,与Avonex®相比,1 mg剂量和0.5 mg剂量Zeposia®均使主要终点ARR(治疗24个月期间的年复发率)实现显著降低:Avonex®治疗组ARR为0.28,1 mg剂量Zeposia®治疗组ARR为0.17(p<0.0001),0.5 mg剂量Zeposia®治疗组ARR为0.22(p=0.0167);使新的或扩大的T2病灶数量(次要终点)显著降低42%(p<0.0001)和34%(p=0.0001),同时分别使钆增强的MRI病灶数量显著降低53%(p=0.0006)和47%(p=0.0030)[5]。
Zeposia®是可以每日服用一次的药物,是不需要患者在开始用药之前进行基因测试或在首次服用后进行观察的S1P受体调节剂。
2.Isatuximab-irfc

Isatuximab于2020年3月2日获得美国食品药品监督管理局(FDA)批准上市,联合Pomalidomide和Dexamethasone治疗既往接受过至少两种疗法(包括Lenalidomide和蛋白酶体抑制剂)的多发性骨髓瘤成人患者。该药由赛诺菲开发并上市销售,商品名为Sarclisa®[6]。
多发性骨髓瘤是第二常见的血液系统恶性肿瘤,在美国影响了13万多患者。每年约有32000名美国人被诊断出患有多发性骨髓瘤。尽管目前有可用的治疗方法,但多发性骨髓瘤仍然是无法治愈的恶性肿瘤,并会给患者带来极大的负担[7]。
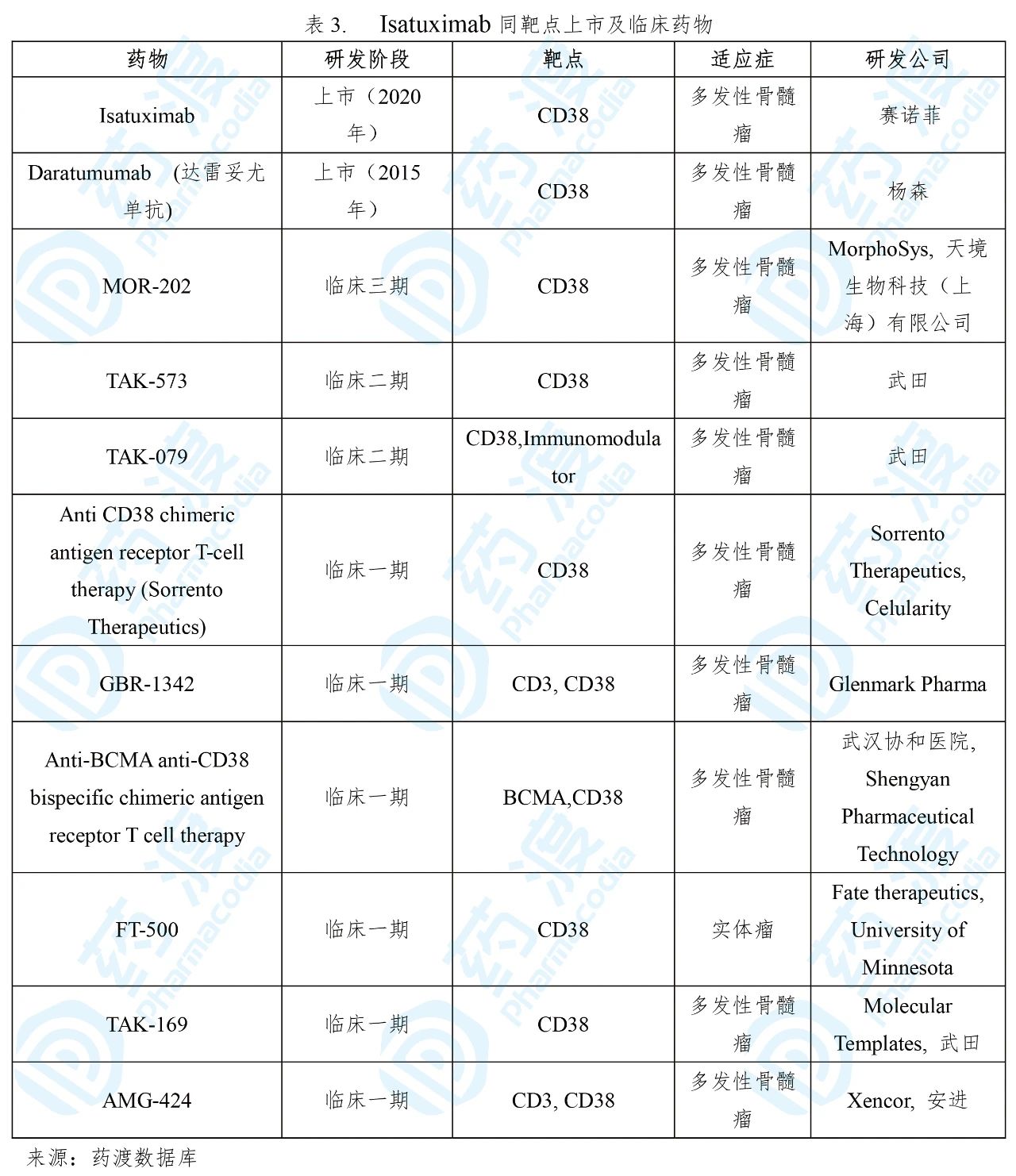
Sarclisa®是一种嵌合的IgG1型的单克隆抗体,可与造血和肿瘤细胞(包括多发性骨髓瘤细胞)表面表达的CD38结合并抑制CD38的ADP-核糖基环化酶活性。Sarclisa®诱导肿瘤细胞凋亡并激活免疫效应机制,包括抗体依赖性细胞介导的细胞毒性作用(ADCC),抗体依赖性细胞吞噬作用(ADCP)和补体依赖性细胞毒性作用(CDC)。Sarclisa®可以在没有CD38阳性靶肿瘤细胞的情况下激活自然杀伤(NK)细胞,并抑制CD38阳性调节性T细胞[8]。
Sarclisa®获批是基于一项国际多中心、随机、开放标签、双臂、临床三期试验ICARIA-MM(NCT02990338),在该研究中Sarclisa®加入pomalidomide-dexamethasone(Sarclisa®联合疗法)后,无进展生存期(PFS)在统计学上有显着改善,中位PFS为11.53个月,而单独使用pomalidomide-dexamethasone则为6.47个月(HR 0.596, 95%CI:0.44-0.81,p = 0.0010)。与单独的pomalidomide-dexamethasone相比,Sarclisa®联合疗法还显示出明显更高的总体缓解率(60.4%对35.3%,p <0.0001)[8,9]。
Sarclisa®的上市为难治性多发性骨髓瘤患者提供了新的治疗选择。
3.Almonertinib Mesilate
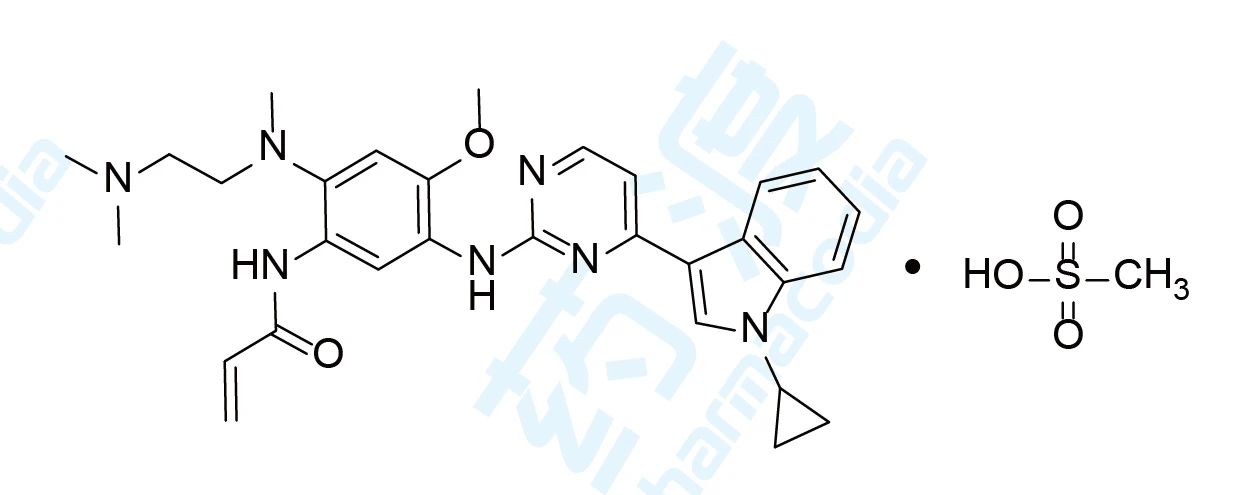
甲磺酸阿美替尼于2020年3月获得国家药品监督管理局(NMPA)批准上市,用于治疗T790M 突变阳性的非小细胞肺癌。该药由江苏豪森研发及上市销售,商品名为阿美乐®[10,11,12]。
肺癌仍然是全球与癌症有关的死亡的主要原因。EGFR突变是最常见的突变,约占中国NSCLC患者的40%,用第一代或第二代EGFR-TKI治疗后,约有50%的NSCLC患者会产生耐药性[13]。

阿美乐®的获批是基于一项多中心、开放标签、双臂的APOLLO临床二期试验。在这项研究中,总共244例患者接受了110mg的Almonertinib治疗。主要终点是由盲法独立中心评审(ICR)确定的客观缓解率(ORR),主要的次要终点包括通过ICR评估的PFS,疾病控制率(DCR),反应持续时间(DoR)和总生存期(OS)。在APOLLO试验中,CNS转移患者的ORR为68.9%,DCR为93.4%,mPFS为12.3个月,ORR为61.5%[14]。
甲磺酸阿美替尼片是全球第二个三代 EGFR-TKI 创新药,也是全球首个中位无进展生存期(mPFS)超过 1 年(二线使用)的三代 EGFR-TKI。甲磺酸阿美替尼的获批上市,给临床医生提供强效、安全和可及的新型选择,为更多晚期非小细胞肺癌(NSCLC)患者带来长期、高质量生存的希望。
4.Bencycloquidium Bromide

苯环喹溴铵于2020年3月获得国家药品监督管理局(NMPA)批准上市,用于减轻及改善变应性鼻炎引起的流涕、鼻塞、鼻痒和喷嚏症状。该药由银谷制药研发及上市销售,商品名为必立汀®[15,16]。
变应性鼻炎又称为过敏性鼻炎,是发生于鼻粘膜的变态反应性疾病,临床主要表现为打喷嚏、流鼻涕、鼻塞和鼻痒。作为我国主要的呼吸道慢性炎性疾病之一,过敏性鼻炎近年来患病率快速上升。据统计,目前我国成人中约1.5亿人受到鼻炎困扰,中重度过敏性鼻炎患者超过600万人[17]。
苯环喹溴铵是一种新型的、高选择性的M1/M3胆碱能受体拮抗剂,可介导支气管收缩和黏液分泌,因可选择性拮抗M1和M3受体而不影响M2受体。该药毒副作用低,使用安全,适用人群广泛,值得临床推广使用,是一种理想的抗胆碱能受体药物,为广大过敏性鼻炎患者提供了一种新的选择,有巨大的市场前景。
5.Tepotinib hydrochloride hydrate
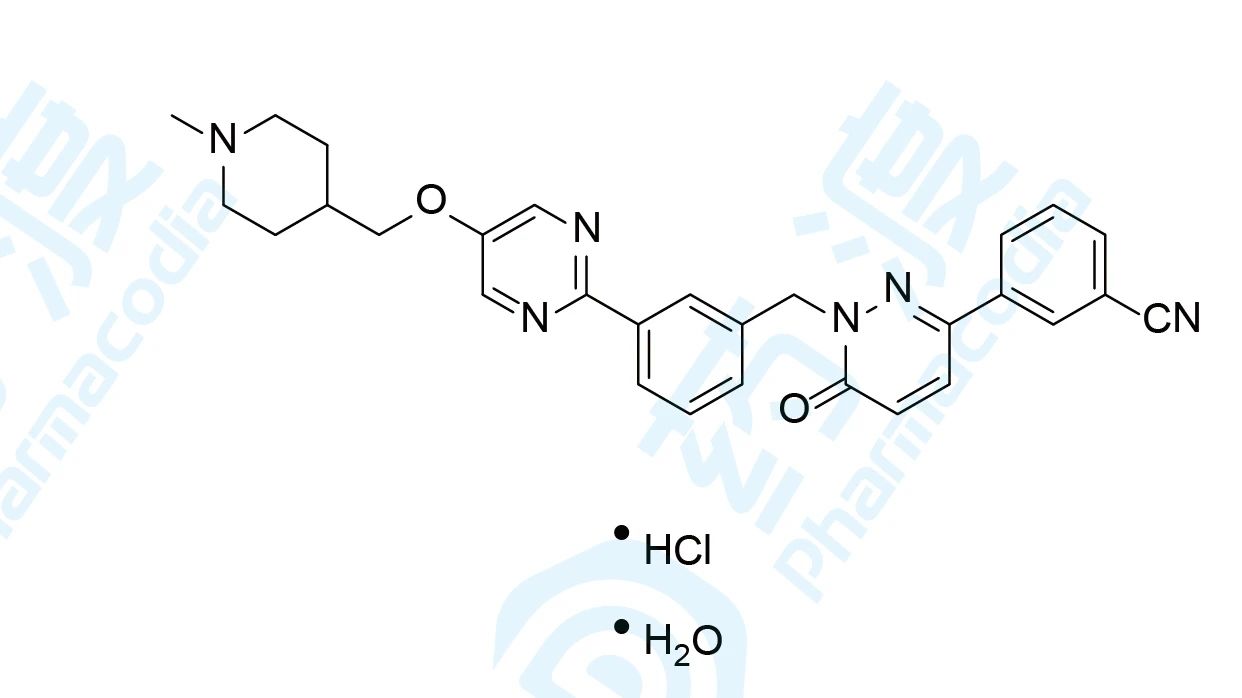
Tepotinib hydrochloride hydrate于2020年3月25日获得日本医药品医疗器械综合机构(PMDA)批准上市,用于治疗MET基因外显子14跳跃突变阳性的不可切除的晚期或复发性非小细胞肺癌。该药由默克雪兰诺研发及上市,商品名为Tepmetko®[18,19]。
在全球范围内,肺癌已经是最常见的癌症类型,也是导致癌症死亡的首要原因。2018年全球确诊200万例,死亡170万例。目前,在众多的类型癌症中,已发现了3种MET信号通路可发生改变(包括METex14跳跃改变、MET蛋白过度表达、MET扩增),这与肿瘤的侵袭行为和不良的临床预后有关。据估计,MET信号通路改变发生在3-5%的非小细胞肺癌患者中[20]。
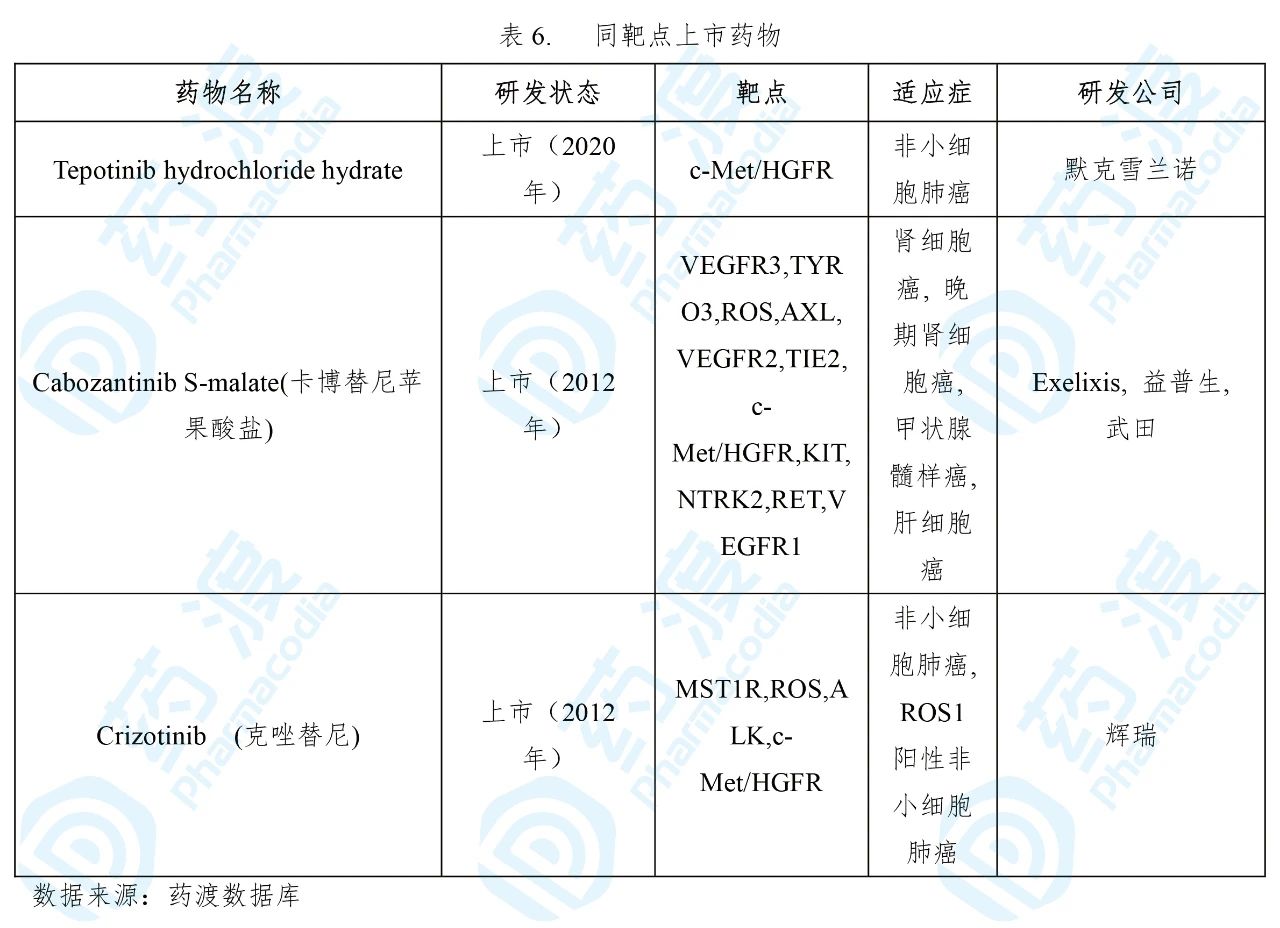
Tepmetko®的获批是基于一项单臂二期VISION研究(NCT02864992)。该研究共入组了99例携带METex14跳跃改变的NSCLC患者(其中包括15例日本患者),结果显示:根据独立评审委员会(IRC)评估,Tepmetko®治疗的客观缓解率(ORR)为42.4%(95% CI:32.5,52.8);在液体活检、组织活检识别的患者中,中位缓解持续时间(DOR)均为12.4个月。除此之外,Tepmetko®的耐受性良好,治疗中出现的最常见不良事件为外周水肿、恶心和腹泻[20]。
Tepmetko®是全球第一个被批准用于治疗携带MET基因改变的晚期NSCLC患者的口服MET抑制剂。
6.Tirabrutinib hydrochloride

Tirabrutinib于2020年3月25日获得日本医药品医疗器械综合机构(PMDA)批准上市,用于治疗复发或难治性的原发性中枢神经系统淋巴瘤。该药由小野制药研发及上市销售,商品名为Velexbru®[21,22]。
原发性中枢神经系统淋巴瘤(PCNSL)是中枢神经系统肿瘤中非常少见的一类肿瘤,约占脑肿瘤的2%,发病率约为0.44/10万。PCNSL患者出现的个体症状因病变部位而异,包括神经精神症,局部神经病变以及与颅内压增高相关的症状,如癫痫发作,眼部症状,头痛,运动困难,颅神经病和神经根病等[23]。

Velexbru®的获批是基于一项多中心、开放标签、单臂的临床一/二期研究。该研究共入组了44例复发性或难治性PCNSL患者,这些患者被分配服用Velexbru® 320 mg(20例患者)、480 mg(7例患者)、480 mg(空腹服药,17例患者),每日口服一次,直至观察到疾病进展或者不可接受的毒性。结果显示,根据独立审查委员会(IRC)的评估,在空腹服用每日一次480mg剂量Velexbru®治疗的17例患者中,总缓解率(ORR)为52.9%(n=9/17)。研究中,11.8%(n=2/17)的患者发生3-4级中性粒细胞减少、白细胞减少和高甘油三酯血症[24]。
Velexbru®是全球第一个被批准用于治疗复发性或难治性PCNSL的BTK抑制剂。
7.Cabotegravir/Rilpivirine

Cabotegravir/Rilpivirine于2020年3月18日获得加拿大卫生部批准,用于治疗成人HIV-1感染,由ViiV Healthcare研发与上市销售,商品名为Cabenuva®。此外,该公司同期获批了单药Cabotegravir,商品名为Vocabria®[25,26]。
艾滋病(AIDS)自1981年首次被发现,到目前虽然不能从根本上治愈,但科学家和临床工作者们却找到了有效控制艾滋病病毒传播途径的药物-采用"高效联合抗病毒疗法"去控制病毒的生长,这要求患者需要终生同时服用多种药物,因此促进了全球范围内抗艾滋病病毒药物需求的增长[27]。

Cabenuva®的获批是基于一项全球性的关键性三期ATLAS(抗长效抗逆转录病毒疗法)和FLAIR(首个长效注射方案)的研究。该研究包括来自16个国家的1100多名参与者。在启动Cabenuva®治疗前,口服Cabotegravir和Rilpivirine导入治疗一个月,以评估Cabotegravir和Rilpivirine的耐受性。研究表明,在整个48周的研究期间内,每月注射一次Cabenuva®,与继续每日口服抗逆转录病毒治疗方案在维持HIV-1成人感染者病毒学抑制方面具有一致的疗效 [28]。
Cabenuva®是全球第一个完整长效的HIV治疗方案,将为HIV患者带来极大的便利,将每天口服转变为每月注射一次。
参考资料
1. 药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PN0870.html(accessed March 2020).
2. BMS官网:https://news.bms.com/press-release/corporatefinancial-news/us-food-and-drug-administration-approves-bristol-myers-squibbs(accessed March 2020).
3. National Multiple SclerosisSociety官网:https://www.nationalmssociety.org/Treating-MS/Medications(accessed March 2020).
4. 美通社:https://www.prnasia.com/story/237837-1.shtml(accessed March 2020).
5. 新基官网:https://ir.celgene.com/press-releases-archive/press-release-details/2019/US-FDA-and-EMA-Accept-Applications-for-Ozanimod-for-the-Treatment-of-Relapsing-Forms-of-Multiple-Sclerosis/default.aspx
6. FDA官网:https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/209899s000lbl.pdf(accessed March 2020).
7. 药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PB0338.html(accessed March 2020).
8. SANOFI官网:https://www.sanofi.com/en/media-room/press-releases/2020/2020-03-02-19-51-16(accessed March 2020).
9. SANOFI官网:https://www.sanofi.com/en/media-room/press-releases/2019/2019-07-10-07-00-00(accessed March 2020).
10. FDA官网:https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/761113s000lbl.pdf(accessed March 2020).
11. 药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PN4103.html(accessed March 2020).
12. 豪森药业官网:http://www.hansoh.cn/news/512572.htm(accessed March 2020).
13. 翰森药业官网:http://www.hspharm.com/upload/file/2020/03/19/623fcd5f508246c5ba49b4a03daee665.pdf(accessed March 2020).
14. FN官网:https://www.finanznachrichten.de/nachrichten-2020-03/49149009-hansoh-pharma-s-ameile-almonertinib-receives-marketing-authorization-in-china-for-second-line-treatment-for-patients-with-egfr-t790m-mutation-non-sm-008.htm(accessed March 2020).
15. PR Newswire官网:https://www.prnewswire.com/news-releases/hansoh-pharmas-ameile-almonertinib-receives-marketing-authorization-in-china-for-second-line-treatment-for-patients-with-egfr-t790m-mutation-non-small-cell-lung-cancer-301026745.html(accessed March 2020).
16. 药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PN1833.html(accessed March 2020).
17. 银谷制药官网:http://www.yingupharm.com/news/89.html(accessed March 2020).
18. 刘志连,刘继文.《变应性鼻炎现状分析》.新疆中医药,2011,05. (accessed March 2020).
19. 药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PN1136.html(accessed March 2020).
20. PMDA官网:https://www.pmda.go.jp/PmdaSearch/iyakuDetail/ResultDataSetPDF/380079_42910E0F1028_1_01(accessed March 2020).
21. Merck KGaA官网:https://www.emdgroup.com/en/news/tepotinib-25-03-2020.html(accessed March 2020).
22. 药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PN1198.html(accessed March 2020).
23. PMDA官网:https://www.pmda.go.jp/PmdaSearch/iyakuDetail/ResultDataSetPDF/180188_42910E1F1022_1_02(accessed March 2020).
24. 于垚,高旭光.原发性中枢神经系统淋巴瘤诊断及治疗进展.中华肿瘤防止杂志,2019,16. (accessed March 2020).
25. Ono Pharmaceutical官网:https://www.ono.co.jp/eng/news/pdf/sm_cn200325.pdf(accessed March 2020).
26. 药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PN1276.html(accessed March 2020).
27. 药渡数据:https://data.pharmacodia.com/web/basic/basic_detail_PC1882.html(accessed March 2020).
28. 马其三,王正平,李金亮,赵燕娜,赵玉萍,韩军.抗艾滋病药物的现状与挑战,聊城大学学报,2020,01. (accessed March 2020).
29. ViiV Healthcare官网:https://viivhealthcare.com/en-gb/media/press-releases/2020/march/viiv-healthcare-announces-first-global-regulatory-approval-of-ca/(accessed March 2020).
关键词:新药
分享至:
![]()
![]()




鄂公网安备 42011102004299号
© 2014-2024 前衍化学科技(武汉)有限公司 版权所有 鄂ICP备20009754号-1